
Migranten, reizen
Dengue / De ontwikkeling van vaccins
Dengue of knokkelkoorts is momenteel wereldwijd de frequentst door muggen overgebrachte virusinfectie. De incidentie is de voorbije decennia sterk toegenomen. De ziekte is in vele tropische en subtropische gebieden in volle expansie. Ook steeds meer reizigers naar deze gebieden lopen risico om besmet te worden. Er bestaat momenteel één vaccin dat alleen in endemische gebieden kan gebruikt worden en dat niet geschikt is voor reizigers. Maar er zitten veel nieuwe vaccins in de pijplijn.
Dengue (en chikungunya) zijn virale infecties die worden overgebracht door de Aedesmug, de gelekoortsmug (Aedes aegypti), en de Aziatische tijgermug (Aedes albopictus), die overdag steken.
Dengue wordt zelden direct van mens op mens overgedragen. Er zijn sporadische gevallen beschreven van nosocomiale mucocutane overdracht in een ziekenhuissetting, van perinatale overdracht, overdracht via bloedproducten en/of donororganen/weefsel.
Dengue virussen behoren tot het genus Flavivirus, met vier serotypes die tegelijk voorkomen. Recent is een vijfde serotype ontdekt. Dit vijfde serotype heeft een ‘sylvatische’ cyclus, wat betekent dat het voornamelijk circuleert tussen niet-humane primaten. Tot op heden is slechts één uitbraak bij de mens met serotype 5 beschreven (1, 2).
Immuniteit
- Bij infectie door een denguevirus treden zowel het adaptief (verworven) als het aspecifieke (aangeboren) immuunsysteem in werking om de infectie te klaren.
- Infectie door een van de vier serotypes van het denguevirus (primaire infectie) geeft een langdurige bescherming tegen symptomatische infectie door datzelfde serotype (homotypische immuniteit). Immuniteit tegen de andere serotypes is echter voorbijgaand (ca 2 jaar). Na een eerste infectie blijft men dus vatbaar voor een nieuwe (secundaire) infectie met een ander serotype (heterotypische herinfectie).
- Antilichamen tegen eiwitten op het oppervlak van het denguevirus kunnen bij een secundaire infectie met een ander serotype een ernstiger infectie veroorzaken. Dit fenomeen, bekend als ’antibody dependent enhancement’, ontstaat door een verhoogde opname van virusdeeltjes in cellen met immunoglobuline-receptoren.
- De ernst van een dengue-infectie is gecorreleerd aan zowel het gehalte als de kwaliteit van de virus-specifieke T lymfocyten reactie.
- Alhoewel hemorragische koorts kan optreden bij een infectie door alle denguevirus serotypes, hebben prospectieve studies aangetoond dat het risico het grootst is bij het virusserotype 2.
- Uit epidemiologische studies blijkt dat het risico op een ernstige infectie groter is bij een secundaire (heterotypische) infectie dan bij een primaire infectie.
- Symptomatische dengue door een derde of vierde heterotypische infectie na een tweede infectie, is zeer zeldzaam. Vermoed wordt dat een tweede (heterotypische) infectie de niet-specifieke immuniteit versterkt en bijkomende bescherming biedt tegen de overblijvende serotypes (multitypische immuniteit) (3; 6).
Epidemiologie
Dengue is endemisch in meer dan 100 landen in Zuidoost-Azië, Midden- en Zuid-Amerika, de westelijke Stille Oceaan, Afrika en het oosten van de Middellandse Zee (4, 7, 8).
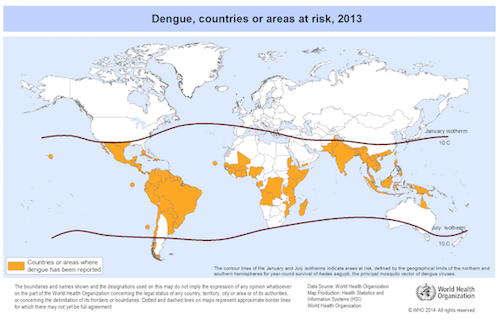
Het aantal dengue-infecties is de afgelopen decennia zeer sterk toegenomen. Dengue is vandaag de snelst verspreidende door muggen overgedragen virusziekte ter wereld. In de laatste 50 jaar is de incidentie met een factor 30 toegenomen, waarbij het virus zich ook verspreid heeft naar landen en regio’s waar de ziekte voorheen niet voorkwam.
Wereldwijd leven ongeveer 2,5 miljard mensen in dengue-endemische landen waarbij jaarlijks naar schatting minstens 390 miljoen infecties optreden, waarvan ongeveer 100 miljoen symptomatische gevallen, ruim 3 miljoen ernstige zieken en 9000 tot mogelijk 25.000 overlijdens, vooral jonge kinderen (7, 8, 9).
De geografische uitbreiding van de ziekte heeft onder meer te maken met de toename van urbanisatie, internationaal verkeer van mensen in de incubatieperiode en afname van de effectiviteit van muggenbestrijding. Het internationale transport van oude autobanden, met regenwater een ideale broedplaats voor de mug, zou een substantiële bijdrage hebben geleverd aan de intercontinentale verspreiding (1, 3).
Ook in Europa zijn de vectoren voor dengue, Aedes aegypti en A. albopictus, (opnieuw) aanwezig. Uit gegevens van de ECDC (4, 7) blijkt dat A. aegypti na jaren afwezigheid opnieuw aanwezig is in Madeira en zich over meerdere landen zal kunnen verspreiden. A. albopictus is aanwezig in meerdere Zuid-Europese landen, onder meer Zuid-Frankrijk, Spanje, Italië, Griekenland en Kroatië.
De voorbije jaren werden in België sporadisch muggen en larven van A. albopictus aangetroffen na import via gebruikte banden en bamboeplanten, maar de muggen hebben zich niet gevestigd. Dengue is bij ons dan ook een importziekte.
- In 2010 was er een uitbraak van autochtone gevallen in Frankrijk en Kroatië, te wijten aan A. albopictus.
- In 2012 trad er een belangrijke uitbraak op in Madeira, Portugal, met meer dan 2100 gevallen, waaronder 87 toeristen.
- In 2013 meldde Frankrijk één autochtoon geval van dengue, in 2014 vier gevallen en in 2015 zeven gevallen, in de Provence-Alpes-Côte-d’Azur regio (10).
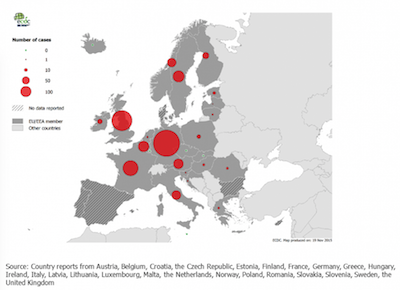
- In 2014 werden er in heel Europa 1796 gevallen van Dengue gemeld, waarvan er 1510 werden bevestigd. De overgrote meerderheid van de gevallen (1403) betrof importgevallen, vier gevallen waren autochtoon; van 76 gevallen was de plaats van infectie onbekend. Het grootste aantal gevallen werd gemeld in Duitsland (626), gevolgd door het Verenigd Koninkrijk (376) en Frankrijk (212). De meeste gevallen worden gemeld in de zomermaanden en in januari en februari, wat waarschijnlijk te maken heeft met buitenlandse reizen (7).
Aantal bevestigde gevallen van Dengue, EU/EEA 2014
Bron: ECDC. Annual epidemiological report 2015. Dengue. Stockholm: ECDC 2016.
Een Nederlandse prospectieve studie uit 2011 onder 1200 reizigers toonde aan dat 1,2 procent van de reizigers een dengue-infectie doormaakte, waarvan een derde symptomatisch. De geschatte incidentie was 14,6 per 1000 persoonsmaanden (1)
In België zijn er in 2016 117 gevallen van dengue gerapporteerd. Alle gevallen werden opgelopen in het buitenland, voornamelijk in Zuidoost-Azië (vooral Thaïland en Indonesië) en Latijns-Amerika (Brazilië, Dominicaanse Republiek, Cuba en Costa Rica) en in mindere mate in Afrika en de westelijke Stille Oceaan.
Grafiek: Jaarlijkse evolutie van dengue in België
Bron: Referentielaboratorium/NRC voor Dengue
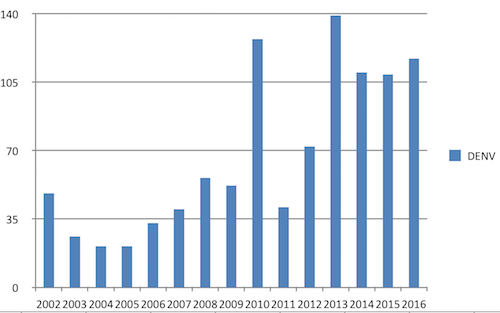
Het werkelijk aantal gevallen van dengue ligt waarschijnlijk veel hoger, omdat niet in alle gevallen laboratoriumdiagnostiek wordt verricht en de diagnose niet altijd zal worden overwogen. Daarnaast kunnen reizigers gezien de korte incubatietijd de ziekte op reis doormaken (3).
In Vlaanderen en Brussel moet elk geval van dengue worden gerapporteerd via de verplichte melding, terwijl in Wallonië alleen autochtone gevallen moeten worden gemeld.
Klinische presentatie
De incubatieperiode voor dengue ligt tussen 3-14 dagen, maar meestal tussen de 4-7 dagen, na een steek van een geïnfecteerde mug.
Niet symptomatisch
Ongeveer 40-80 procent van de geïnfecteerde personen vertoont geen symptomen.
Niet ernstige of ongecompliceerde dengue
Het overgrote deel van de geïnfecteerde personen met symptomen heeft milde verschijnselen.
Klassiek verloopt de ziekte volgens een bifasisch patroon. Maar in de praktijk ziet men dat niet zo vaak.
In zijn typisch verloop wordt dengue gekenmerkt door een brutaal begin met een grippaal syndroom:
- koorts (tot 41 °C),
- hoofdpijn (met name retro-orbitaal),
- bot- en gewrichtspijn (’knokkelkoorts’), met name lumbosacraal,
- belangrijke spierpijn (o.a. lendenpijn),
- pijn rondom de oogbollen,
- soms een droge hoest,
- vertraagde hartslag (relatieve bradycardie),
- een musculair exantheem.
Vervolgens treedt er klinische verbetering op, maar kan er terug een verergering optreden met een maculopapulair (morbilliform) niet-jeukend exantheem (vergelijkbaar met mazelen) op romp en later op ledematen en gezicht; handpalmen en voetzolen blijven veelal vrij. Herstel hiervan gaat soms met schilfering gepaard.
Herstel is in ongecompliceerde gevallen snel en volledig. Tijdens de tweede exantheemfase kan er ook weer een verhoging van de lichaamstemperatuur optreden, zogenaamde zadelkoorts.
Het bloedbeeld laat leukopenie met een relatieve lymfomonocytose, trombocytopenie en parenchymateuze leverenzymstoornissen zien.
De herstelfase duurt meestal lang. Er kan een wekenlange periode van moeizaam herstel volgen, gekenmerkt door vermoeidheid, spierpijnen en neuralgieën. Ook soms na enkele maanden haarverlies, wat spontaan herstelt.
Ernstige dengue
Zeldzaam (minder dan 5 %) kunnen ernstige levensbedreigende vormen optreden. Ernstige dengue begint als een ongecompliceerde dengue, maar na 2-5 dagen verslechtert de patiënt snel met een verhoogde bloedingsneiging (petechiën of neusbloedingen), ernstige plasmalekkage met shock tot gevolg en/of kans op ernstige beschadiging van vitale organen zoals hersenen, lever of hart. Indien onbehandeld is de mortaliteit 10 procent. Bij een goede behandeling (snel toedienen van de juiste hoeveelheid vocht via infuus) neemt dat af tot 1 à 2 procent.
De incidentie van deze levensbedreigende vormen is de voorbije 20 jaar duidelijk toegenomen.
Individuele risicofactoren voor een ernstig beloop zijn:
- aanwezigheid van heterotypische antistoffen (door eerdere infectie of maternale antistoffen);
- leeftijd: vooral jonge kinderen zijn minder goed dan volwassenen in het compenseren van capillaire lekkage en lopen derhalve een groter risico op ernstige dengue;
- (mogelijk) chronische aandoeningen (astma, sikkelcelanemie en diabetes mellitus).
Diagnostiek (3)
Diagnostiek van dengue gebeurt door detectie van het virus zelf en/of serologie.
In de acute fase van de ziekte (eerste week na start koorts) kan de diagnose gesteld worden met PCR en/of antigendetectie. Het dengue NS1-antigen is iets langer detecteerbaar dan het virale RNA. De detectie van het NS1-antigen gebeurt daarenboven met een sneltest wat een snelle diagnostiek mogelijk maakt. PCR heeft een hogere gevoeligheid en specificiteit dan de antigendetectie en biedt het voordeel dat bepaling van het dengue serotype mogelijk is.
Daar patiënten zich meestal pas vaak na de acute fase bij een dokter melden, is men voor de diagnostiek vaak aangewezen op serologie. Dengue IgM-antistoffen zijn detecteerbaar vanaf de vijfde tot zevende ziektedag, dengue IgG-antistoffen een paar dagen later. De detectie van antilichamen gebeurt met ELISA. Sommige laboratoria maken gebruik van een IgM/IgG-sneltest. Als enkel IgM-antistoffen aanwezig zijn, is het omwille van mogelijk vals-positieve resultaten, aangewezen een week later een opvolgstaal te laten testen om seroconversie van de IgG-antilichamen aan te tonen. Serologie heeft het nadeel dat kruisreactie met andere flavivirussen kan optreden. Deze kruisreactie is meer uitgesproken bij IgG- dan IgM-antilichamen.
Richtlijnen voor staalafname en vervoer:
Voor serologie en/of PCR is een bloedstaal van minimum 1 ml nodig. De bloedstalen moeten bij 4 °C bewaard worden in afwachting van verzending. Transport kan bij kamertemperatuur gebeuren, behalve indien het tijdsinterval > 24 uur bedraagt (bewaring op -20 °C en transport op droog ijs). De transittijd moet zo kort mogelijk gehouden worden, waarbij vervoer tijdens het weekend of feestdagen moet vermeden worden.
Omdat de uitgevoerde test afhankelijk is van het interval tussen het begin van de symptomen en de staalafname, is het belangrijk om de datum van eerste ziektetekens op het aanvraagformulier te vermelden.
¬
Het Nationaal Referentiecentrum (NRI) voor dengue is het
Instituut voor Tropische Geneeskunde - Klinische Biologie
Dr. M. Van Esbroeck
03 247 64 45
Behandeling
Er bestaat geen specifieke antivirale behandeling van dengue. De aandoening geneest meestal vanzelf.
De behandeling is symptomatissh, met rehydratie bij koorts. Men mag bij de behandeling van denguekoorts geen aspirine gebruiken omwille van de verhoogde bloedingsneiging, maar enkel paracetemol voor de koorts (11).
Bij ernstige dengue is een opname in een ziekenhuis nodig voor vochttoediening via infuus.
Preventie
De enig mogelijk individuele preventiemaatregel bestaat tot nu toe uit antimugmaatregelen in endemische en epidemische gebieden van zonsopkomst tot schemering, met name in de vroege ochtend en namiddag.
Voor muggenwerende maatregelen, zie Instituut voor Tropische Geneeskunde:
http://www.itg.be/Files/docs/Reisgeneeskunde/NMAATREGELEN.pdf
Dengue vaccinatie
Er wordt al jaren gezocht naar een werkzaam vaccin tegen dengue. Vaccinatie vermindert op individueel niveau de kans op infectie en/of vermindert de ernst van de ziekte in geval van infectie. Het vermindert ook de kans dat een geïnfecteerd persoon het virus doorgeeft aan muggen, waardoor de virale druk vermindert, wat ervoor kan zorgen dat niet-gevaccineerde personen onrechtstreeks beschermd worden (6, 12).
Er bestaat momenteel één levend afgezwakt (recombinant) tetravalent vaccin tegen dengue (CYD-TDV / Dengvaxia®, Sanofi).
Daarnaast zijn er meerdere nieuwe vaccins in ontwikkeling.
De ontwikkeling van vaccins tegen dengue blijft evenwel een grote uitdaging (13, 14, 15, 16, 17).
- Het vaccin moet langdurige bescherming bieden tegen de vier bekende serotypes van het denguevirus.
- Het mag het risico op een ernstige infectie bij seronegatieve personen niet verhogen.
- Het is momenteel nog niet duidelijk hoe de ernstige vorm van de ziekte ontstaat en hoe het virus interageert met het immuunsysteem.
- Er bestaat momenteel nog geen immunologische correlatie van bescherming van denguevaccins, zoals de aanwezigheid van antilichamen. Er bestaan ook geen adequate diermodellen die kunnen voorspellen of een vaccin zal beschermen.
- Het vaccin mag niet te duur zijn vermits dengue het meest voorkomt in eerder arme landen.
Dengvaxia®
Dengvaxia is geïndiceerd voor personen van 9 tot 45 of 60 jaar (afhankelijk volgens de registratie) die in endemisch gebied leven. Het wordt subcutaan toegediend in drie dosissen met 6 maanden interval (0-6-12). De beschermingsduur van dit vaccin is nog niet bekend.
Deze vaccinatie is niet geïndiceerd voor reizigers omwille van de beperkte effectiviteit en de afwezigheid van natuurlijke boosters (11).
Dengvaxia is tot nu toe in negentien landen geregistreerd. Het is momenteel beschikbaar in Mexico, Indonesië, Thailand, Paraguay, Peru, Costa Rica, El Salvador en Guatemala. In twee landen, Brazilië en de Filippijnen, wordt het gebruikt in vaccinatieprogramma’s in endemische gebieden voor kinderen vanaf 9 jaar. Sindsdien werden in de Filippijnen bijna 734.000 kinderen gevaccineerd. In december 2017 besliste de Filippijnse overheid evenwel om dat programma op te schorten na berichten over ernstige bijwerkingen bij personen die voor vaccinatie geen dengue-infectie hadden doorgemaakt (Zie verder ‘Veiligheid’).
Werkzaamheid
Op basis van meerdere fase 3-studies (18, 19, 20, 21) bij meer dan 35.000 kinderen tussen 2 en 14 jaar of tussen 9 en 16 jaar oud in 10 endemische gebieden in Azië en Latijns-Amerika bedraagt de werkzaamheid van Dengvaxia tegen virologisch bevestigde dengue-infecties in de 25 maanden na de eerste dosis gemiddeld 60,3 procent.
- De reductie in symptomatische dengue bedroeg gemiddeld 57 tot 65,6 procent.
- Het aantal ernstige gevallen van dengue daalde met 79,1 procent in alle leeftijdsgroepen en met 93,2 procent in de leeftijdsgroep van 9 jaar of ouder.
- Het aantal hospitalisaties daalde met 72,7 procent in alle leeftijdsgroepen en met 80,8 procent in de leeftijdsgroep van 9 jaar of ouder.
De werkzaamheid van het vaccin variëert naargelang het land, serotype, ernst van de infectie, eerdere blootstelling aan dengue en leeftijd.
- Land. De werkzaamheid van het vaccin variëert van 79 procent in Maleisië tot 31,3 procent in Mexico.
- Serotype. Het vaccin biedt betere bescherming tegen serotype DENV-3 (71,6 %) en DENV-4 (76,9 %) dan tegen DENV-1 (54,7 %) en DENV-2 (43 %)
- Blootstelling aan dengue. De werkzaamheid is veel hoger bij seropositieve proefpersonen (81,9 %) dan bij seronegatieve personen (52,5 %).
Seropositieve patiënten hebben een tot tienmaal hogere antistoffentiter na elke vaccindosis dan seronegatieve patiënten, bij wie de antistoffentiter ook sneller vermindert. Dit doet vermoeden dat het vaccin eerder de bestaande immuniteit versterkt dan wel de de novo beschermende immuniteit verhoogt (12). - Leeftijd. De werkzaamheid van het vaccin daalt met de leeftijd: 66 procent voor kinderen die ouder waren dan 9 jaar, 45 procent voor kinderen jonger dan 9 jaar en 33,7 procent voor kinderen tussen 2 en 5 jaar. Dat kan mogelijk verklaard worden door het feit dat veel jongere kinderen seronegatief waren op het ogenblik van vaccinatie. Andere mogelijke factoren zijn een leeftijdsspecifieke gevoeligheid en afname van de bescherming (’waning’).
Veiligheid en beperkingen
• Bijwerkingen van het vaccin zijn vergelijkbaar met de bijwerkingen van andere levend afgezwakte vaccins. De meest voorkomende bijwerkingen zijn: hoofdpijn (> 50 %), malaise (> 40 %), myalgia (> 40 %) en koorts (5-16 %). Lokale reacties (vooral pijn) kwamen voor bij 45 tot 49 procent van de deelnemers (9).
• Vaccinatie zou mogelijk werken als een stille natuurlijke infectie waardoor seronegatieve personen bij de eerste blootstelling aan het natuurlijke virus in feite een herinfectie of secundaire infectie doormaken (12, 21).
Bij routinevaccinatie van seronegatieve personen verhoogt bij een nieuwe infectie de kans op een ernstige infectie en hospitalisatie. Uit nieuwe gegevens van producent Sanofi na vijf jaar follow-up wordt dit risico geschat op 2 extra gevallen per 1000 niet-eerder geïnfecteerde personen. Daarom heeft Sanofi besloten om de ‘labeling’ van het vaccin aan te passen. Toediening van het vaccin wordt afgeraden bij personen die niet eerder een bewezen dengue-infectie hebben gehad.
In een voorlopig advies – in afwachting van een volledige review van de nieuwe veiligheidsdata – raadt de Wereldgezondheidsraad aan om Dengvaxia alleen toe te dienen aan personen in hoog-endemisch gebied waarvan bekend is dat ze eerder besmet zijn geweest met dengue. Een nieuw SAGE-advies en een update position paper van de WHO worden in de loop van 2018 verwacht, zodra de veiligheidsgegevens opnieuw geanalyseerd zijn door een extern team.
Volgens de WGO is dit risico reëel bij kinderen jonger dan 9 jaar. Daarom is het vaccin alleen geïndiceerd voor kinderen van 9 jaar en ouder.
Op basis van de huidige studies is dit risico zeer klein bij oudere kinderen, zeker in hoog-endemische gebieden. In laag-endemische gebieden kan echter niet uitgesloten worden dat systematische vaccinatie de incidentie van ernstige infecties en hospitalisatie zou kunnen verhogen (12, 22). Volgens een aantal studies is dit ook in hoog-endemische gebieden een niet te verwaarlozen risico (24, 25, 26), maar dit wordt betwist (27).
Serologische tests voor vaccinatie zouden een oplossing kunnen zijn om de voordelen van vaccinatie te maximaliseren en de nadelen te minimaliseren. Op die manier zou men kunnen vermijden om seronegatieve kinderen te vaccineren. Voor seropositieve personen zou mogelijk één vaccindosis kunnen volstaan voor een afdoende bescherming. Bovendien zou men personen die reeds een secundaire infectie hebben doorgemaakt, en bij wie de kans op een nieuwe symptomatische infectie zeer klein is, kunnen uitsluiten (12, 28, 29).
Maar in de praktijk zijn de beschikbare tests duur en is het logistiek een zeer moeilijke operatie (27).
WGO standpunt
De WHO Strategic Advisory Group of Experts on Immunization (SAGE) bracht in april 2016 een gemotiveerd advies uit over het gebruik van CYD-TDV (9, 30, 31). Volgens de WHO kan de introductie van een vaccinatieprogramma voor 9-jarigen in hoog-endemische gebieden (SP ≥ 70 %) het aantal gevallen van symptomatische dengue en hospitalisaties over een periode van 30 jaar met 10 tot 30 procent verminderen.
- Gebruik van dit vaccin moet overwogen worden voor personen tussen 9 en 45 jaar in endemische landen of streken waar op basis van epidemiologische gegevens een hoge ziektelast bestaat.
- De seroprevalentie moet 70 procent of meer bedragen in de leeftijdsgroep die gevaccineerd wordt. Vaccinatie van populaties met een seroprevalentie tussen 50 en 70 procent is aanvaardbaar, maar de impact zal veel kleiner zijn. Vaccinatie wordt niet aanbevolen wanneer de seroprevalentie lager is dan 50 procent omwille van het verhoogde risico op een ernstiger ziekteverloop bij seronegatieve personen.
- Dengue vaccinatie moet onderdeel zijn van een globale strategie, met onder meer een adequate vectorcontrole, een sterke dengue surveillance en een goede behandeling van geïnfecteerde patiënten.
Nieuwe vaccins in ontwikkeling
Er zijn momenteel meerdere nieuwe dengue-vaccins in ontwikkeling (6, 13, 14, 15, 16, 17, 32).
Drie kandidaat vaccins zitten momenteel in een klinische ontwikkelingsfase (Fase 2 en 3). Twee levend afgezwakte (recombinante) tetravalente vaccins (TV003 van het Butantan Institute in Thailand en TVD van Takeda) worden nu in meerdere landen getest (fase 3) (33, 34). Een derde vaccin (TV003/TV005 van NIAD) zit momenteel in een fase 2-stadium (35).
Een aantal andere vaccins waarbij verschillende technieken worden gebruikt (recombinant subunit, plasmid DNA, klassieke inactivatietechnieken...), verkeren nog in fase 1 of een preklinische fase (nog niet getest op mensen).
Bronnen
1. RIVM. Dengue Richtlijn.
2. Mustafa MS, Rasotgi V, Jain S et al. Discovery of fifth serotype of dengue virus (DENV-5): A new public health dilemma in dengue control. Med J Armed Forces India. 2015. 71(1): 67-70.
3. Agentschap Zorg & Gezondheid. Richtlijn Infectieziekten Vlaanderen - Dengue. Versie 2016.
4. ECDC. Factsheet about dengue fever.
5. Schwartz LM, Halloran ME, Durbin AP, Longini IM Jr. (2015) The dengue vaccine pipeline: Implications for the future of dengue control. Vaccine 33(29): 3293–3298.
doi: 10.1016/j.vaccine.2015.05.010. pmid:25989449
6. S.B. Halstead. Identifying protective dengue vaccines: guide to mastering an empirical process. Vaccine, 31 (2013), pp. 4501-4507
7. ECDC.Dengue Fever - Annual Epidemiological Report 2016.
8. www.who.int/denguecontrol/epidemiology/en
9. WHO. Dengue vaccine: WHO Position Paper. Weekly Epidemiological Record. 30 (91): 349-364
10. Institut de Veille Sanitaire
11. Itg. www.itg.be/Files/docs/Reisgeneeskunde/Ndengue-chik.pdf
12. Ferguson NM, Rodriguez-Barraquer I, Dorigatti I, Mier YT-RL, Laydon DJ, et al. Benefits and risks of the Sanofi-Pasteur dengue vaccine: Modeling optimal deployment. Science. 2016; 353 (6303): 1033–1036. doi: 10.1126/science.aaf9590. pmid:27701113
13. www.who.int/immunization/research/development/dengue_vaccines/en/
14. Vaccine Special Issue: The development of dengue vaccines. Vaccine 2011. 29 (42): 7219-7284.
15. Vannice KS, Durbin A & Hombach J. Status of vaccine research and development of vaccines for dengue. Vaccine. 2016. 34(26) : 2934-2938. https://doi.org/10.1016/j.vaccine.2015.12.073
16. Ramakrishan L, Pillai MR & Nair RR. Dengue vaccine development: strategies and challenges. Viral Immunol. 2015. 28(2):76-84. doi: 10.1089/vim.2014.0093.
17. Betancourt-Cravioto M, Falcón-Lezama JA & Tapia-Conyer R. Roadmap for the Introduction of a New Dengue Vaccine. In: Sperança MA (ed). Dengue - Immunpathology and Control Strategies. Intech 2017. Ch 8.
18. Capeding MR, Tran NH, Hadinegoro SR et al. Clinical efficacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia: a phase 3, randomised, observer-masked, placebo-controlled trial. Lancet 2014. 384(9951): 1358-1365. DOI: http://dx.doi.org/10.1016/S0140-6736(14)61060-6
19. Villar L, Dayan GH, Arredondo-García JL et al. Efficacy of a Tetravalent Dengue Vaccine in Children in Latin America. N Engl J Med. 2015. 372 (2): 113-123.
20. Hadinegoro SR, J.L. Arredondo-García JL, M.R. Capeding MR et al. Efficacy and Long-Term Safety of a Dengue Vaccine in Regions of Endemic Disease. N Engl j Med. 2015. 373 (13): 1195-1206
21. Coudeville L, Baurin N, L’Azou M, et al. Potential impact of dengue vaccination: insights from two large-scale phase III trials with a tetravalent dengue vaccine. Vaccine. 2016. 34 (50): 6426–6435. DOI:10.1016/j.vaccine.2016.08.050
22. Flasche S, Jit M, Rodríguez-Barraquer I, Coudeville L, Recker M, Koelle K, et al. (2016) The long-term safety, public health impact, and cost-effectiveness of routine vaccination with a recombinant, live-attenuated dengue vaccine (Dengvaxia): a model comparison study. PLoS Med 13(11):e1002181. doi: 10.1371/journal.pmed.1002181.
23. Halstead S. B. Protective and Immunological Behavior of Yellow Fever Dengue Chimeric Vaccine. Vaccine. 2016. 34(14), 1643–1647.
24. Aguiar M, Stollenwerk N, Halstead SB. The impact of the newly licensed dengue vaccine in endemic countries. PLoS Negl Trop Dis. 2016;10(12):e0005179. doi:10.1371/journal.pntd.0005179
25. Aguiar M, Stollenwerk N, Halstead SB (2016) The risks behind Dengvaxia recommendation. Lancet Infect Dis 16(8): 882–883. doi: 10.1016/S1473-3099(16)30168-2. pmid:27477967
26. Halstead SB. Critique of World Health Organization Recommendation of a Dengue Vaccine. J Infect Dis. 2016; 214(12):1793-1795. https://doi.org/10.1016/j.vaccine.2015.05.010
27. Wilder-Smith A, Vannice KS, Hombach J, Farrar J, Nolan T. Population Perspectives and World Health Organization Recommendations for CYD-TDV Dengue Vaccine. J Infect Dis. 2016; 214(12):1796-1799 E-pub ahead of print. doi: 10.1093/infdis/jiw341. pmid:27496977
28. Aguiar M, Halstead SB, Stollenwerk N. Consider stopping dengvaxia administration without immunological screening. Expert Rev Vaccines. 2017. 16 (4): 301-302. http://dx.doi.org/10.1080/14760584.2017.1276831
29. Deen J. The Dengue Vaccine Dilemma: Balancing the Individual and Population Risks and Benefits.PLoS Med. 2016; 13(11): e1002182. doi:10.1371/journal.pmed.1002182
30. World Health Organization Strategic Advisory Group of Experts (SAGE) on Immunization. Background paper on Dengue Vaccines prepared by the SAGE working group on dengue vaccines and the WHO secretariat. 2016
31. Pang T. SAGE committee advice on dengue vaccine. Lancet Infect Dis. 2016; 16: 880–882. doi: 10.1016/S1473-3099(16)30167-0. pmid:27477966
32.Dengue Vaccine Initiative
33. Sirivichayakul C, Barranco-Santana EA, Esquilin-Rivera I, Oh HM, Raanan M, et al. Safety and Immunogenicity of a Tetravalent Dengue Vaccine Candidate in Healthy Children and Adults in Dengue-Endemic Regions: A Randomized, Placebo-Controlled Phase 2 Study. J Infect Dis. 2016; 213(10): 1562–1572. doi: 10.1093/infdis/jiv762. pmid:26704612
34. Whitehead SS, Durbin AP, Pierce KK et al. In a randomized trial, the live attenuated tetravalent dengue vaccine TV003 is well-tolerated and highly immunogenic in subjects with flavivirus exposure prior to vaccination. PLoS Negl Trop Dis. 2017. 11(5):e0005584. doi: 10.1371/journal.pntd.0005584.
35. Kirkpatrick BD, Durbin AP, Pierce KK et al. Robust and Balanced Immune Responses to All 4 Dengue Virus Serotypes Following Administration of a Single Dose of a Live Attenuated Tetravalent Dengue Vaccine to Healthy, Flavivirus-Naive Adults. J Infect Dis 2015. 212(5): 702–710. doi: 10.1093/infdis/jiv082. pmid:25801652
36. http://mediaroom.sanofi.com/information-update-on-dengvaxia/
37. http://www.who.int/immunization/diseases/dengue/q_and_a_dengue_vaccine_dengvaxia/en/
Zoeken
Abonneer u op de nieuwsbrief
 Vax Info
Vax Info Zika: nieuw reizigersadvies HGR
Zika: nieuw reizigersadvies HGR